물의 물리화학적 성질(physicochemical properties of the water)
물은 분자량이 비슷한 다른 분자들에 비교해서 독특한 여러 가지 물리화학적 특성을 가지고 있다. 이러한 특성들은 다른 원소들이 산소와 화학결합을 할 때 다른 원소들의 전자구름을 왜곡하는 데 영향을 끼치는 산소원자의 크기와 핵의 대전으로부터 생기는 것이다.
공유결합은 두 원자사이에서 공유되는 전자쌍이다. 물 분자에서 수소원자의 전자는 산소원자의 전자와 하나씩 공유가 되며, 산소원자의 나머지 4개의 전자는 2개의 비공유 쌍으로 남게 된다.
이와 같이 산소원자는 음전하를 띤 4쌍의 전자쌍으로 둘러 싸이게 되며 각 쌍들은 반발력을 최소화 하기 위하여 가능한 멀리 떨어져 배열된다.
그 결과 각 전자 쌍간의 각도가 109 도인 사면체의 기하구조를 형성하게 된다. 그렇지만 2개의 비공유전자 쌍은 산소원자 가까이에 남게 되기 때문에 다른 두 공유 쌍에 더 강한 반발력으로 작용하여 결국 수소 원자들을 서로 가까이 밀게 된다.
이런 이유로 H-O-H간의 각도가 104.5 도인 찌그러진 사면체의 기하구조를 형성하게 되는 것이다.

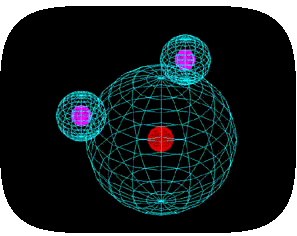
물 분자는 전기적으로는 중성이지만 양성전하와 음성전하는 균등하게 분포되어 있지 않다.부분적으로는 비공유 전자쌍(그림에서 우측의 파란색)과, 전자를 강하게 끌어당기는 산소원자핵 전하로 인하여 물 분자에서 전자(음성)는 산소말단에 밀집되어 있다.(아래그림)
이러한 전하 이동은 전기적 쌍극자를 형성하며 물 분자의 전기적 이미지로 생각할 수 있다.
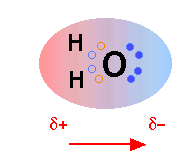
반대 전하끼리는 서로 끌어 당기기 때문에 물 분자에서 부분적으로 양전하를 띤 수소원자는 다른 물 분자의 부분적 음전하를 띤 산소에 정전기적으로 이끌리게 된다. 이러한 결합을 수소 결합이라고 하는데 그림에서 보는 것처럼 수소와 산소간의 공유결합(H-O)의 길이 99pm(picometer)에 비하여 좀 길기 때문에 (117pm) 결합력은 비교적 약하다.

화학자들이 생각하는 물의 성질
액체 상태의 물의 성질과, 액상에서 물 분자의 구성은 화학자들에게는 오랫동안 흥미있는 관심거리였다. 그리하여 물에 관하여 아래와 같은 특성을 정리하였다.
- 물 분자는 수소결합으로 알려진 양극자-양극자간의 작용으로 서로 끌어 당긴다.
- 물 분자는 포텐셜 에너지가 가장 낮은 4면체로 존재하는 것이 이상적이지만 각 분자들은 열운동을 하기 때문에 극히 짧은 순간만 (10 -12초, picoseconds) 구조를 유지한다
- 적외선 흡수, 중성자 분산, 핵자기 공명, 컴푸터 시뮬러이션과 같은 다양한 방법으로 물 분자의 물리적 특성연구 결과 물분자의 수소결합은 picosecond의 시간 범위 내에서 끊임 없이 결합 형성/결합 붕괴가 일어나기 때문에 물분자의 구조라는 개념은 시간대와 부피의 개념에서 존재하는 클러스터(cluster)로 설명된다.
- 구조라는 개념은 시간적차원에서 모양을 유지하지만 클러스터는 한시적인 구조를 설명한다.
에너지와 기하학적 관점에서 주위 물분자와의 관계는 특정한 작은 부피 내에서만 설명이 가능하다.
- 1950년대의 설명에서는 다양한 크기의 명멸하는 클러스터의 집합으로 해석.

- 1980년대의 설명은 피코초 이하의 시간 범위내에서 물분자는 "겔" 양상을 나타내며 커다란 수소결합 클러스터를 형성하는 데 10 -12 - 10 -9초 범위에서는 열운동, 회전으로 수소결합 붕괴, 재결합으로 새로운 입체구조를 형성한다.(온도와 압력에 의하여 영향을 받음)
80년대의 이론적 모델에 따르면 물분자는
0도에서 평균 클러스터 크기는 90 H20
70도에서 25분자 이상을 못 넘는다.
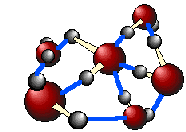
Martin Chapin 교수는 정20면체의 클러스터링 모델로 설명하였는 데
물분자는 14단위의 사면체단위 20개가 정20면체 형성 (280개 물분자)한다고 하였다. (아래그림)
- 2004년도 모델은 femptosecond time scale 에서 물분자의 구조를 설명하였으며 80%의 물분자는 체인 모양으로 결합, 상온에서 역동적인 비정형적인 물구조를 형성한다.
액체와 고체상태의 물 구조
얼음:하나의 물분자 주위에 네개의 물분자가 둘러싸고 있는 구조로 두개의 물분자는 산소 원자에 수소결합을 하고 두개의 수소원자는 다른 물분자의 산소원자와 수소 결합을 한다.

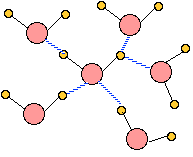
왼쪽은 고체(얼음)상태의 물 구조, 오른쪽은 액체 상태의 물 구조
위의 그림과 같은 구조로 산소원자를 중심으로 주위로 네개의 물 분자가 둘러싸는 4면체 구조를한다. 얼음 결정에서는 이와 같은 구조가 연속적으로 반복된다.
얼음이 녹게 되면 열운동이 수소결합을 파괴 하기 때문에 입체적인 4면체 구조가 붕괴된다. 그렇기 때문에 물의 미세구조를 설명할 수 있는 단정적인 방법은 없으며 이와 같은 배열이 주위 물분자의 어느 정도까지 계속되는 지는 알 수 없다.
아래 그림은 물의 부분적 입체구조이다.(왼쪽-액체) (오른쪽-고체)

물의 불규칙적인 특성
알려진 화학물질 1500만 종 중에서 물은 액체상태가 고체 상태보다 부피가 작은 독특한 물질이다. 일반적으로 물질은 열을 흡수하게 되면 열 운동으로 인하여 분자간의 거리가 길어지고 따라서 부피가 증가하게 되지만 물의 경우는 온도에 따라서 특이한 양상을 나타낸다.
얼음상태에서는 부피가 9% 증가하는 데 이로 인하여 수도관의 동파가 일어나며, 물병이 얼어서 터지게 되고 또한 물위에 얼음이 뜨게 되는 것이다.
-4도에서 0도 사이의 부피 팽창은 더 커다란 클러스터 형성으로 인한 것이다. 4도시 이후의 열팽창은 O-H 결합이 더욱 격렬하게 되어 열진동의 시작으로 분자간의 거리가 더욱 멀어지게 된다.

또 다른 중요한 특성중의 하나는 비등점이 매우 높다는 점이다. 일반적으로 물정도의 분자량을 가지는 물질은 수소 결합이 없다면 영하 90도 근처에서 끓어서 상온에서는 기체 상태로 존재하게 될 것이다.
표면장력과 침수
물위를 걷는 곤충을 본적이 있을 것이다. 소금쟁이 같은 곤충들은 물 표면의 탄성필름과 같은 성질을 이용하여 물에 빠지지 않고 걷는다. 이러한 성질은 물의 표면장력에서 설명이 가능하다. 물표면에 존재하는 물분자와 물속에 존재하는 물분자 사이에는 서로 다른 인력이 작용한다. 물속의 물분자는 사방에서 인력을 받는 반면, 표면의 물분자는 측면과 아랫쪽으로 인력이 작용하여 팽팽한 막 효과(stretched-membrane effect)를 나타낸다.
표면에 존재하는 분자와 내부에 존재하는 분자 사이의 차이는 물분자에서 두드러지는 데 이것은 강력한 수소결합력에서 기인한 것이다. 이러한 차이에 의하여 액체의 표면장력이 발생하게 되는 것이다.

- 인력(attraction)과 장력(tension)
예를 들면 축구공이 구를 유지하기 위해서는 공기압은 장력으로 작용, 가죽 껍데기는 인력을 발생시켜야 형태 유지가 가능하다. 두 힘이 균형을 이루지 못하면 공은 팽창해서 터지거나 수축해서 쭈그러진다. 물방울의 경우 물의 질량은 장력으로 작용하며 물의 수소결합, 반데르발스력 등은 인력으로 작용한다. 물의 질량이 커져서 장력이 인력보다 커지게 되면 구 형태는 붕괴된다. (위 그림 참고)
-소금쟁이가 물에서 뜨는 이유
각 구는 인력과 장력이 균형을 유지하며(A) 구와 구 사이에는 인력이 작용(B). 물 안쪽의 구는 상하, 좌우로 인력이 작용하지만 물표면의 구는 윗 쪽에서 작용하는 인력이 없다. 그렇기 때문에 윗 쪽으로는 인력크기만큼(B만큼)의 장력이 발생(C)하며 이 장력정도의 질량을 가진 물체는 물의 표면장력으로 인하여 뜨게 된다.(아래 그림참고)

보다 큰 개체가 물에 빠지지 않고 뜨는 데는 다른 물리적인 현상으로 설명을 할 수 있다. 조류가 물에 빠지지 않는 것은 조류의 털은 소수성이라서 물에 젖지 않을 뿐더러 깃털사이에 아주 미세한 공기 방울은 조류자체의 부력과 합해져서 조류가 물에 빠지지 않게 하는 것이다. 이 경우 물의 표면장력은 미세한 공기 방울과의 사이에만 작용한다.
침수(wetting)
프라스틱 용기에 물을 뿌리게 되면 물은 플라스틱 용기 표면에 작은 방울을 형성하는 것을 볼 수 있을 것이다. 마찬가지로 깨끗하지 않은 자동차 앞 유리에 빗방울이 떨어질 때도 물은 평평하게 퍼지지 않고 방울을 형성하는 것을 볼 수 있다. 그렇지만 깨끗한 유리표면에 물을 뿌리게 되면 물은 유리 표면에 얇게 퍼져서 막을 형성하는 것을 볼 수 있다.
액체가 고체 표면과 접하게 되면 두 물질의 친화도에 따라 양상은 달라지는 데, 표면장력이 두 물질사이의 인력보다 상대적으로 커지게 되면 액체는 방울을 형성하게 된다. 물이 소수성 플라스틱 표면과 접하게 되면 인력이 없기 때문에 물은 자체의 모양을 유지하게 되지만 깨끗한 유리표면은 이와는 대조적으로 -OH가 노출되어 있기 때문에 유리표면은 물과 수소결합으로 평평하게 퍼지게 되는 것이다.
일반적으로 물에 젖지 않는 표면을 적시게 하려면 세제를 표면에 처리한다. 그렇게 되면 세제의 소수성 꼬리는 소수성 표면과 작용하게 되고 친수성 머리는 물과 수소결합을 하여 표면과 인력(attraction)을 발생하게 되는 것이다.
바이오 워터와 결정수
액상의 물은 다양한 크기의 사슬모양그룹이 시트를 형성하며 picosecond의 범위 내에서 명멸(flicker)한다. 그러나 고체의 표면이나 다른 분자 또는 비평형적인 전하(unbalanced electric charge)를 띈 이온의 근처에 있는 물분자는 편향되거나 상대적으로 안정적인 구조로 결합되기도 한다.
이온성 수화각(shell)에서의 물
물분자는 전기적으로 대전된 원자 또는 분자의 이온과 강하게 작용한다. 소금이 물에서 녹으면 Na와 Cl 이온을 함유하는 용액이 된다. 강력한 극성 때문에 용해된 이온 가까이의 물분자는 이온에 강력하게 결합하여 일차 수화각(primary hydration shell)을 형성하게 된다. Na와 같이 양성으로 대전된 이온은 아래 그림과 같이 물분자의 음성말단(산소)을 잡아 끈다.
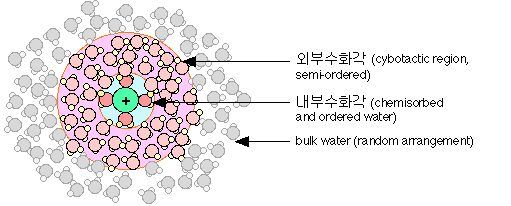
일차수화각 내부의 정렬된 구조는 수소결합을 통하여 주변의 물을 어느 정도까지 정렬시키는, 즉 cybotactic region 또는 외부 수화각을 형성하게 된다.
* cybotactic region
용액 주위의 용매는 용액의 성질로 인하여 물리 화학적성질이 영향을 받게되어 원래의 용매 성질과는 다른 용매의 성질을 나타내게 된다.
생물계에서의 결합수
세포내에서 막이나 다른 세포소기관 가까이 접해 있는 세포내의 수분은 일반적인 물과는 다른 구조를 하고 있다고 알려져 있으며 이러한 구조화된 물은 생체물질의 구조나 활성에 중요한 역할을 하는 것으로 알려져 있다. 그렇지만 중요한 것은 이 부위의 물 구조는 주변 수소결합의 기하학적 구조에서 기인하는 것이다.
물분자는 자체로 수소결합을 하지만 -OH 또는 -NH2 기를 가지는 모든 분자와 수소결합을 할 수 있다. 예를 들면 알코올, 유리표면 그리고 단백질과 같은 거대분자 등과 수소결합을 한다. 단백질의 생물활성은 조성뿐만 아니라 이 분자가 접히는 양상에 따라 달라지는 데, 주름 형성에는 물분자와의 수소결합 그리고 분자의 다른 부위와의 수소결합이 관련되어 있다. 분자내부의 수소결합을 파괴하는 모든 인자는 단백질을 변성시키며 단백질의 활성을 변화시킨다. 계란의 흰자는 열을 받거나 다른 요인으로 인하여 변성되면 단백질 내부의 수소결합이 파괴되고 구조가 변하게 된다. 이렇게 되면 물분자와의 수소결합도 파괴되어 물에 녹지 않는 단백질로 되며 원래의 친수성 단백질로 되돌아 갈수 없게 된다.

왼쪽 그림은 U. Mass Medical School의 William Royer Jr의 연구 결과인데 이 그림은 헤모글로빈 단백질 이합체 사이에 존재하는 물분자(녹색의 원) 구조를 나타낸 것이다.
가는 점선은 수소결합을 나타내며, 헴단백질 골격의 수소결합 부위의 기하학적 구조로 인하여 이 부위의 물분자는 수소결합으로 안정화되어 구조는 고도로 정렬(ordered) 되어있으며, 그 결과 헤모글로빈 이합체의 구조를 기하학적으로 안정화 시켜 준다.
2003년 미국 인디아나주의 화학자는 적절한 분자골격은 물분자가 염주모양의 구조를 형성할 수 있게 해 주며 그 결과 물은 큰 분자내부의 빈 공간으로 스며들 수 있게 된다는 연구 결과를 발표하였다.(아래그림)

클러스터, 비클러스터 그리고 구조가 다르게 변형된 물
건강관련제품시장에는 물의 구조를 안정화 시켜서 자연상태에 존재하는 10-15분자의 클러스터를 영구적으로 4-8분자의 클러스터 구조로 만든다는 제품들이 많이 있다. 물분자를 작은 구조의 덩어리로 만들고자 하는 목적은 세포내로의 유입을 용이하게 하기 위한 것이지만 과학적으로는 넌센스라고 할 수 있다. 이러한 말도 안되는 이론에 근거한 특허제품이 미국에서도 "Clustered Water TM"으로 팔리고있다. 물론 한국에도 자화수나 육각수 제조기라는 이름으로 특허까지 취득해서 버젓이 팔리고있는 것을 볼수 있다.
앞에서도 언급을 했지만 물의 구조는 나노 또는 피코초에서 일어나는 사건이며 온도가 상승하면 열운동으로 그 구조가 다양하게 변한다. 특정 형태의 구조체는 일정한 온도, 특별한 환경아래서 매우 짧은 순간에 존재할 수 있는 것이기 때문에 그렇게 형성된 자화수나 육각수를 음용하거나 다른 환경으로 이동하게 되면 구조가 변하게 된다는 사실을 알아야 할 것이다.
참고자료
Water Clusters. K. Liu, J.D. Cruzan, and R.J. Saykally. Science 1996 929-993 - A summary of experimental data on the structures, energetics and dynamics of small clusters, and comparisons with theoretical predictions.
Cell-associated water. W. Drost-Hansen, J. Clegg, ed. Academic Press, 1979.
'과학 science' 카테고리의 다른 글
| 진화하는 물 (0) | 2021.06.26 |
|---|---|
| 우리는 물에 대해 얼마나 알고 있을까? (0) | 2021.06.26 |
| 물의 과학 (0) | 2021.06.06 |
| 물의 특성 (0) | 2021.05.30 |
| 물의 4번째 상태| 제럴드 폴락 박사 | TEDxGuelphU (0) | 2020.12.16 |